Atrofia muscular espinal (AME): la importancia de un diagnóstico precoz
La lista de genes causantes de enfermedades neuromusculares, es decir, aquellas que afectan a la unidad motora (células del asta anterior de la médula espinal, nervios periférico, la unión neuromuscular y el músculo), ha crecido de manera casi exponencial la última década. Sin embargo, hasta hace muy poco, no disponíamos de grandes opciones terapéuticas para enfermedades como la atrofia muscular espinal (AME), la distrofia muscular de Duchenne (DMD) o la Enfermedad de Pompe, a pesar del conocimiento de sus bases genéticas.
Afortunadamente, en los últimos años han surgido nuevas terapias capaces de modificar el curso clínico de algunas de estas enfermedades.
Los nuevos tratamientos aprobados para la atrofia muscular espinal (AME) marcan un antes y un después en el tratamiento de las enfermedades neuromusulares, y son uno de los mayores éxitos de la terapia dirigida genéticamente, al ser capaces convertir una enfermedad mortal (AME tipo I) en una condición tratable.
Cada agosto se celebra mundialmente el mes de concientización de la atrofia muscular espinal (AME), de ahí que dediquemos esta nueva entrada al blog.
¿Qué es la Atrofia Muscular Espinal?
La atrofia muscular espinal (AME) es una enfermedad neuromuscular de herencia autosómica recesiva, causada por la perdida de las dos copias del gen SMN1 (“survival motor neuron”) localizado en brazo largo del cromosoma 5, generalmente por delecciones (95%), que cursa con degeneración y pérdida de las neuronas motoras inferiores (células del asta anterior) de la médula espinal y los núcleos del tronco encefálico, produciendo atrofia y debilidad muscular simétrica progresiva de inicio y gravedad variable.
Aunque se considera una enfermedad rara, la AME es una de las enfermedades hereditarias neuromusculares más frecuentes. Afecta a uno de cada 6000-10000 recién nacidos y tiene una frecuencia de portadores de 1 por cada 40 o 50 individuos de la población general.
Aunque todas las formas clínicas de AME tienen ausencia de SMN1, los pacientes siempre tienen entre 1 y 5 copias de un gen adyacente y casi idéntico (SMN2) que participa en la formación de la proteína SMN, y cuyo número de copias se correlaciona con la clínica del paciente (fenotipo).
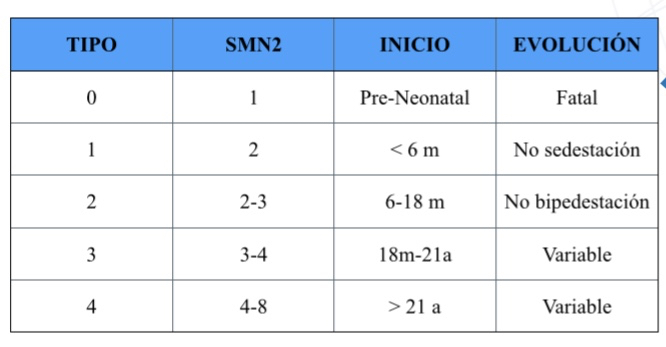
Aunque no siempre es así, los pacientes con la forma más grave de AME, es decir el Tipo 1, tienen en su gran mayoría 2 copias de SMN2. Los pacientes con AME tipo 2 tienen mayoritariamente 3 copias y los pacientes Tipo 3 entre 3 y 4 copias.
Aunque desde el punto de vista clínico la AME consiste en un espectro continuo, se ha clasificado en grandes tipos según la edad de inicio de los síntomas y el pronostico funcional a nivel motor
¿Existe algún tratamiento para el AME?
Hasta 2017, el tratamiento de la AME ha sido de soporte o paliativo, centrando los cuidados en los problemas neuromusulares, problemas respiratorios y digestivos (debilidad muscular, hipoxemia, problemas para la alimentación, enfermedad por reflujo gastroesofágico o estreñimiento).
Pero…En diciembre de 2016, la FDA aprobó el uso del primer medicamento diseñado para tratar específicamente a pacientes con AME: Nusinersen (administración intratecal). A partir de este momento cambia el paradigma del tratamiento de la enfermedad y empieza la nueva era del tratamiento de las enfermedades neuromusculares.
El Nusinersen es un oligonucleotido antisentido que actúa sobre el gen SMN2; aumenta la inclusión del exón 7 en la transcripción del ARN mensajero (ARNm) SMN2 y por lo tanto, aumenta la producción de proteína SMN. Este tratamiento consigue modificar la historia natural de la enfermedad, y permite a los pacientes desarrollar hitos motores nunca alcanzados.
Nusinersen ha sido solo el principio de una serie de tratamientos hasta ahora impensables en Neuropediatría.
En Mayo de 2019, Zolgensma (onasemnogene abeparvovec) de AveXis, fue la primera terapia génica aprobada para el tratamiento de pacientes con atrofia muscular espinal (AME).
Zolgensma es una terapia génica basada en vectores de virus adenoasociados, de administración única intravenosa en niños con atrofia muscular espinal (AME) y mutaciones bielélicas en el gen SMN1 y un diagnóstico clínico AME Tipo I; o para pacientes con mutación bialélica en el gen SMN1 y con hasta tres copias del gen SMN2.
Se administra mediante una sola infusión intravenosa (IV), aportando una nueva copia funcional del gen SMN1 en las células del paciente para detener la progresión de la patología.
Afortunadamente, Zolgensma ha sido también aprobada en Europa por la Agencia Europea del Medicamento (EMA).
Asimismo se están llevando a cabo en la atrofia muscular espinal otros ensayos clínicos y terapias experimentales incluyendo medicamentos por vía oral que modifican la inclusión del exón 7 como el risdiplam (oral)
¿Es importante el diagnóstico precoz?
Los pacientes con AME tipo 1 tienen una pérdida irreversible de las neurona motora de comienzo perinatal, que progresa hacia una intensa denervación en los primeros 3 meses de la vida y una pérdida de más del 90% de la unidad motora en torno a los 6 meses de edad. Con la aparición de las nuevas terapias, un retraso en el diagnóstico, aunque común, es una catástrofe.
Aunque la aparición de los síntomas se produce a una edad media de 2,5, 8 y 39 meses para los tipos 1, 2 y 3 respectivamente, el diagnóstico de AME se confirma en torno a los 6,3, 20,7 y 50,3.
Pare evitarlo y acortar los plazos de diagnósticos que permitan iniciar lo antes posible el tratamiento, es fundamental conocer y detectar de forma precoz los principales signos de alarma.
Signos de alarma del desarrollo psicomotor
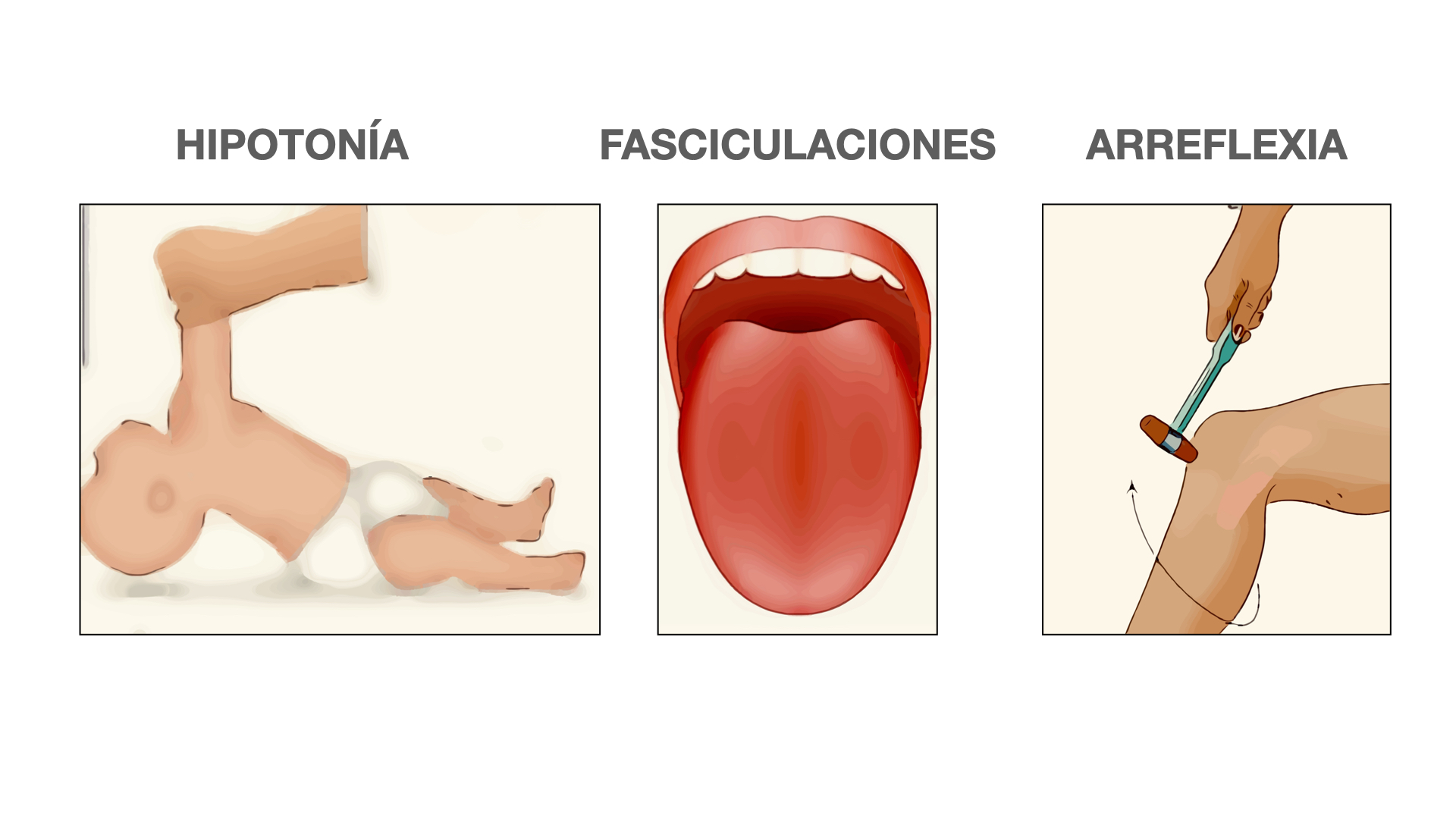
Desde el punto de vista motor y nivel general, el principal signo de alarma es la presencia de un repertorio de movimientos espontáneos pobres o anormales, sobre todo si se acompañan de una disminución del tono muscular (hipotonía “paralítica”).
Si a esto le añadimos la ausencia de reflejos osteotendinosos y fasciculaciones en la lengua, el diagnóstico de AME es casi seguro.
Respecto a los hitos madurativos motores, no sujetar la cabeza en torno a los cuatro meses ni mantenerse sentado después de los nueve meses, así como ausencia de desplazamiento autónomo pasados los diez meses o no caminar solo después de los 18 meses, deben hacernos sospechar que algo no marcha bien.
Por tanto es importante conocer los principales hitos del desarrollo psicomotor y cuando aparecen.
¿Está justificado el cribado neonatal para el AME?
Puesto que el resultado de los nuevos tratamiento es mejor cuanto más temprano se inicia el tratamiento, el cribado neonatal debería ser considero como el mejor instrumento para evitar la odisea diagnóstica.
Aunque probablemente es la mejor opción, no esta exenta de controversias.
1º: Podría pasar por alto algunos casos de AME (por ejemplo aquellos con una mutación puntual)
2ª Podría suponer un exceso de tratamiento. Aunque los “expertos” recomiendan un “tratamiento inmediato” en lactantes con 2 o 3 copias de SMN2, podríamos estar tratando pacientes con AME tipo 3 con una progresión lenta, que van a estar asintomáticos durante años. Para algunos expertos, podría suponer un tratamiento excesivo.
3º Podría plantear un conflicto ético. El diagnóstico temprano de niños con tipos de AME de inicio en la edad adulta, podría quitarles el derecho a decidir por sí mismos si quieren hacerse no las pruebas. Además, corren el riego de ser tratados como si estuvieran enfermos, aunque estén asintomáticos (“síndrome del niño vulnerable”).
4º Podría suponer un problema, cuando es candidato a tratamiento pero su familia no esta de acuerdo con recibirlo. En estos casos se debe informar a los padres sobre los riesgos y beneficios de retrasar el tratamiento y los signos y síntomas de la progresión de la enfermedad que deberían desencadenar un tratamiento inmediato.
CONCLUSIONES
- Se ha avanzado mucho en la comprensión, el diagnóstico y el tratamiento de la AME desde que se describió por primera vez en 1891.
- Su alta incidencia y el beneficio de una intervención temprana, hacen deba considerarse dentro de las enfermedades a incluir en los programas de cribado neonatal.
- Una prueba genética sencilla, puede confirmar en pocos días el diagnostico de AME en el 95% de los casos.
- El diagnostico precoz y el desarrollo de nuevas terapias, han cambiado el escenario hacia la necesidad del tratamiento de los casos presintomáticos.
- Hasta que suceda, el diagnóstico debemos basarse en la clínica y realizarlo de forma precoz. Por ello, es importante conocer los signos de alarma del desarrollo psicomotor y concienciar a los Pediatras de Atención Primaria a cerca de la importancia de derivar precozmente a unidades especializadas para el diagnostico.
Bibliografía
- Finkel RS, Mercuri E, Meyer OH, et al. Diagnosis and management of spinal muscular atrophy: Part 2: Pulmonary and acute care; medications, supplements and immunizations; other organ systems; and ethics. Neuromuscul Disord. 2018;28(3):197-207.
- Mercuri E, Finkel RS, Muntoni F, et al. Diagnosis and management of spinal muscular atrophy: Part 1: Recommendations for diagnosis, rehabilitation, orthopedic and nutritional care. Neuromuscul Disord. 2018;28(2):103-115.
- Ross LF, Kwon JM. Spinal Muscular Atrophy: Past, Present, and Future. Neoreviews. 2019;20(8):e437-e451. doi:10.1542/neo.20-8-e437.
- Tizzano EF, Finkel RS. Spinal muscular atrophy: A changing phenotype beyond the clinical trials. Neuromuscul Disord. 2017;27(10):883-889.


 adrian garcía ron
adrian garcía ron